1. Wstęp
Jest to pierwsza z serii stron pokazanych na tym portalu. Miała powstać, jako pokazanie uproszczenia pewnych idei, które pojawiły się wcześniej, ale były bardziej skomplikowane. Miałem tendencję do upraszczania pierwotnych idei, aby pokazać logiczny zarys struktury moich myśli. Okazało się jednak, że uproszczenie doprowadziło do znacznego poszerzenia pierwotnego obrazu. W miarę coraz dokładniejszej analizy tych na pozór prostych struktur pojawiało się coraz więcej wariantów modeli podstawowych. Jako doświadczony chemik powinienem się właściwie tego spodziewać, jednak nie przypuszczałem, że idea upraszczająca może doprowadzić do takiego rozrostu liczby modeli podstawowych. Te modele wymagały rozsądnej systematyzacji. Struktury zostały utworzone za pomocą edytora ChemSketch. Ich geometria została wstępnie optymalizowana za pomocą wbudowanego w program modułu mechaniki molekularnej.
2. Model wyjściowy
Początkowo sądziłem, że związkiem wyjściowym do dalszych rozważań powinien być tricyklo[3.1.1.12,4]okta-1,4-dienu, którego trójwymiarowy i ruchomy rysunek znajduje się w bazie PubChem:
Jednakże stworzenie systemu pochodnych, który byłby w miarę spójny, wymagało wprowadzenia w pełni nasyconego odpowiednika tego związku, mianowicie tricyklo[3.1.1.12,4]oktanu A.
Z tego związku wyprowadzona została seria pochodnych nienasyconych zawierających jedno, dwa i większą liczbę wiązań podwójnych C=C (w tym pierwszą przytoczoną w tym wpisie strukturę – poniżej oznaczoną jako C). W wyniku analizy zagadnienia wyodrębniłem osiem struktur bazowych A-H, które następnie zostały powielone w celu utworzenia dłuższych łańcuchów węglowodorowych (scheme 1):
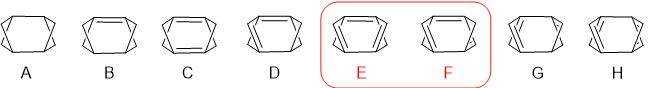
Struktury E i F zawierające układy trienowe zostały ujęte w czerwoną ramkę. Przyczyna tego wyróżnienia zostanie omówiona dalej.
3. Modele A-H i ich rozbudowa
3.1. Model A i jego rozbudowa
Rozbudowa A polega na dołożeniu kolejnej poprzecznej warstwy powiązanej dwoma wiązaniami pojedynczymi, która jest formalnie resztą cyklobutanu. Na schemacie 2 pokazano dobudowanie jednej i dwóch warstw cyklobutanowych do A. Użycie poprzecznych fragmentów cyklobutanu jako wskaźnika opisu cząsteczek rozbudowywanych upraszcza wskazanie, o której cząsteczce jest mowa. Wyjaśniają to zaadaptowane do tych celów diagramy Schlegela modelu A z dwiema, trzema i czterema warstwami cyklobutanu (w tym kontekście model A powinien być oznaczany jako A2 a sam cyklobutan jako A1, ale pozostajemy przy poprzednich oznaczeniach):
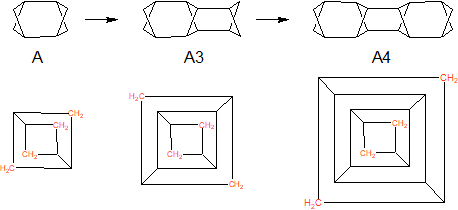
Dodatkowo kolorem czerwonym zaznaczono skrzydłowe grupy metylenowe, które dla parzystych liczb pierścieni poprzecznych układają się schematach Schlegela na jednej prostej, natomiast dla liczb nieparzystych na prostych prostopadłych.
3.2. Rozbudowa modelu B
Model B jest formalnie tricyklo[3.1.1.12,4]okt-1-enu. Pojawienie się jednego wiązania podwójnego w modelu bazowym stwarza szereg możliwości konstrukcji wydłużonych struktur o specyficznej stereochemii. Na schemacie 3 przedstawiono większość modeli B8 (zawierających 8 poprzecznych pierścieni cyklobutanowych). Rozbudowa modeli do ośmiu cykli poprzecznych (cyklobutanu) była konieczna aby pokazać wszystkie możliwości ułożenia wiązań podwójnych wzdłuż cząsteczki (liczbę ośmiu pierścieni poprzecznych zachowano w następnych przykładach):
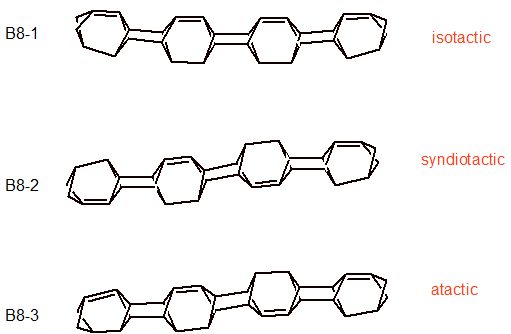
Formalne podobieństwo uporządkowania wiązań podwójnych względem cząsteczki do uporządkowania stereochemicznego grup funkcyjnych w polimerach nasunęło myśl, żeby cząsteczkom B nadać określenia wzięte z taktyczności polimerów. I tak w B8-1 wiązania podwójne znajdują się po jednej stronie cząsteczki (układ izotaktyczny), w B8-2 po dwóch stronach naprzemiennie ( układ syndiotaktyczny). Układ wiązań podwójnych w cząsteczce B8-3 jest rozłożony przypadkowo i odpowiada modelowi ataktycznemu w polimerach.
Nic nie stoi na przeszkodzie, żeby zwiększyć liczbę wiązań podwójnych w B8-1-3 i umieścić je pomiędzy już istniejącymi. Takie zabieg prowadzi do kolejnych struktur B8-4-6:
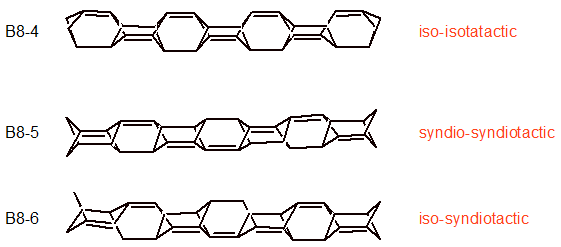
Cząsteczka B8-4 posiada dwa łańcuchy wiązań podwójnych. Oba mają charakter izotaktyczny. W wypadku B8-5 oba łańcuchy są syndiotaktyczne i wreszcie dla B8-6 jeden jest izo- a drugi syndiotaktyczny. Można powiększyć rodzinę tych struktur o modele bardziej randomowe: izo-ataktyczny, syndio-ataktyczny i wreszcie ataktyczno-ataktyczny (powinny być oznaczobe jako B8-7-9). Ne rozpatrujemy ich jednak tutaj. Zwróćmy jednak uwagę na model B8-1. Jest on wygięty (tę sam efekt wygięcia wykazuje model B8-4). Jest to wynik faktu, że wiązania podwójne są krótsze niż pojedyncze. Ułożenie izotaktyczne wiązań podwójnych wymusza zagięcie cząsteczki. Nasuwa to myśl, że możliwa jest konstrukcja makrocyklu przez dołączanie kolejnych cząsteczek B8-1 do siebie i połączenie obu końców przez usunięcie czterech skrzydłowych atomów wodoru.
3.3. Rozbudowa modelu C
Struktury C8-1-5 pokazują sposoby rozbudowy modelu C czyli pokazanego na początku tricyklo[3.1.1.12,4]okta-1,4-dienu. Pokazane pięć możliwości wyczerpuje warianty położenia wiązań podwójnych w układach rozbudowanych (schemat 5):
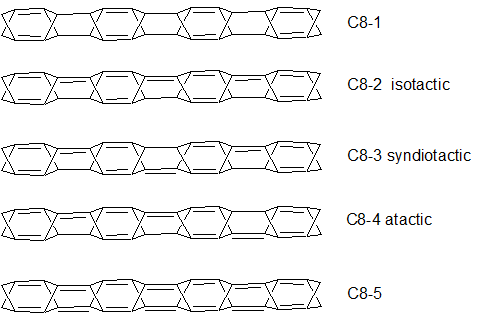
Wśród pokazanych powyżej modeli obliczeniom na poziomach półempirycznym i DFT został poddany model C8-5. Szczególnie interesujące było zachowanie się wiązań podwójnych w tak naprężonym układzie z widocznym sprzężeniem (wyniki obliczeń tego uraz krótszych i dłuższych łańcuchów zostaną omówione dalej).
3.4. Rozbudowa modelu D
W wyniku rozbudowy modelu D otrzymano trzy łańcuchy różniące się wzajemnym położeniem wiązań podwójnych. W celu ich rozróżnienia zastosowano ponownie nomenklaturę pochodzącą z chemii polimerów. Skrzydłowy fragment D w dwoma wiązaniami podwójnymi nazwano „głową” a przeciwny, bardziej nasycony) ogonem. Model D można połączyć na trzy sposoby pokazane na schemacie 6.
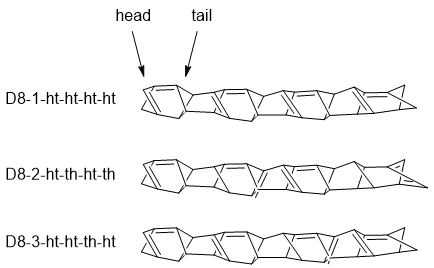
Otrzymuje się układy, w których ogon jest systematycznie połączony z głową (D8-1) albo głowa do ogona, ogon do głowy itd. (D8-2). Ostatni sposób polega na randomowym połączeniu ogona i głowy (D8-3).
3.5. Przypadek modeli E i F
Modele te można nazwać tricyklo[3.1.1.12,4]okta-1,3,5-trienami. Jednakże wystąpienie fragmentu 1,3,5-trienowego w układzie cyklicznym E i F sugeruje jednoznacznie, że mamy tu do czynienia ze zniekształconymi pierścieniami benzenowymi usztywnionymi dwoma mostkami metylenowymi. Bliższa analiza pokazuje, że w E mostki metylenowe są połączone do atomów węgla 1 i 3 oraz 4 i 6 w położeniu cis. Model jest F izomerem trans ze względu na położenie grup metylenowych względem pierścienia benzenowego. Rzeczywiście próba optymalizacji geometrii struktur E i F za pomocą metody PM7 doprowadziła do rozpadu tych struktur na fragmenty. Z tego względu pominięto je w dalszych rozważaniach.
3.6. Rozbudowa modelu G
W modelu G pierścienie poprzeczne mają charakter cyklobutenów i cyklobutadienów. Są to pierścienie mocno naprężone a wypadku cyklobutadienu dodatkowo antyaromatyczne. Tym niemniej w celu systematyzacji utworzono trzy pochodne. Zastosowano do nich nomenklaturę głowa-ogon podobnie jak dla modeli D8 (schemat 7):
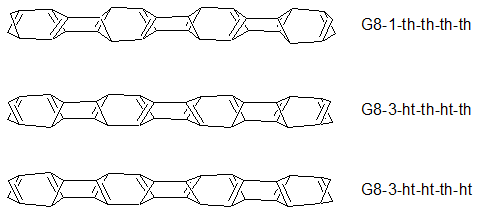
Należy zwrócić uwagę na stereobudowę oligomerów modelu G czyli tricyklo[3.1.1.12,4]okta-1(7)2,5-trienu. Wyjściowa struktura jest chiralna. Atom węgla w pozycji 4 cząsteczki jest centrum stereogenicznym o konfiguracji S (schemat 8):

Możliwa jest zatem konstrukcja oligomerów enancjomerycznych jaki i diastereomerycznych związanych ze zmianą położenia wiązania C=C we fragmencie cyklobutenowym. Tych zagadnień nie rozpatrujemy w niniejszym wpisie.
3.7. Rozbudowa modelu H
Ostatni rozpatrywany tu model (model H) nie posiada atomów wodoru po bokach wewnętrznych fragmentów struktury. Te znajdują się jedynie na skrzydłach (podobnie jak w modelu C8-5). Oligomer skonstruowany został z ośmiu pierścieni poprzecznych. Mają one charakter cyklobutadienów (schemat 9):
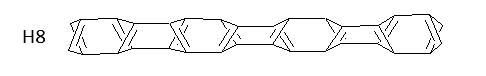
Antyaromatyczny charakter cyklobutadienu sugeruje nietrwałość cząsteczek opartych na jego budowie. Przed obliczeniami nie było jednak jasne, czy taki oligomer rozpadnie się, czy wiązania ulegną jedynie przegrupowaniu. W dalszej części zagadnienia te zostaną omówione bardziej szczegółowo w części drugiej.